Пищевые источники
Ежедневно до четверти минерала от суточной нормы поступает с водопроводной жесткой водой, которая за ночь настаивается в трубах, обогащаясь соединением. Помимо этого, главными пищевыми источниками никеля выступают чистый какао-порошок – 980 мкг на 100 г продукта, горько-сладкий шоколад – 260 мкг (молочный – 120). Причины высокой концентрации элемента в данных изделиях – постоянный контакт сырья с машинами из нержавейки, мощный процесс переработки. Помимо этого, лидерами по содержанию соединения являются бобовые.
| Наименование продукта | Содержание никеля в 100 г продукта, микрограмм |
|---|---|
| Какао-порошок | 980 |
| Кешью | 510 |
| Шпинат | 390 |
| Соя | 304 |
| Шоколад | 120 – 250 |
| Зеленый горошек | 250 |
| Фасоль | 170 |
| Чечевица | 160 |
| Кукуруза | 80 |
| Печень говяжья | 63 |
| Овсяные хлопья | 50 |
| Рис | 50 |
| Пшеница | 40 |
| Фисташки | 40 |
| Рожь | 30 |
| Абрикос | 32 |
| Ставрида холодного копчения | 28 |
| Ячневая крупа | 23 |
| Мука пшеничная | 22 |
| Крупа перловая | 20 |
| Черная смородина | 18 |
| Груша | 18 |
| Яблоко | 18 |
| Виноград | 16 |
| Капуста белокочанная | 15 |
| Свекла | 14 |
| Шпроты в масле | 14 |
| Помидоры | 13 |
| Свинина | 12 |
| Крупа гречневая | 10 |
| Треска, путассу | 9 |
| Говядина | 8,6 |
| Минтай, пикша, хек | 7 |
| Окунь, судак, скумбрия, щука, камбала | 6 |
| Картофель | 5 |
| Персик | 4 |
| Крупа рисовая | 2,7 |
Во избежание перенасыщения рациона никелем и развития симптомов передозировки, рекомендуется исключить из меню продукты с высоким содержанием микроэлемента, заменяя их изделиями с низким % минерала в составе. К таким изделиям относят: лук, капусту, мясо птицы, огурцы, тыкву, морковь, молоко, говядину, колбасы, капусту брокколи. Содержание никеля в данных продуктах не превышает 15 мкг на 100 г пищи.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
К никельсодержащим напиткам относятся пиво, чай, кофе. Потребление «жидких» источников микроэлемента ограничьте до двух-трех чашек в день.
Физические свойства никеля:
| 400 | Физические свойства | |
| 401 | Плотность* | 8,908 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 7,81 г/см3 (при температуре плавления 1455 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1455 °C (1728 K, 2651 °F) |
| 403 | Температура кипения* | 2730 °C (3003 K, 4946 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 17,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 379 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,439 Дж/г·K (при 20°C) |
| 410 | Молярная теплоёмкость* | 26,07 Дж/(K·моль) |
| 411 | Молярный объём | 6,6 см³/моль |
| 412 | Теплопроводность | 90,9 Вт/(м·К) (при стандартных условиях), 90,9 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 13,4 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри* | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Мировое производство
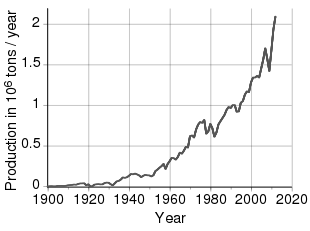
Временной тренд производства никеля
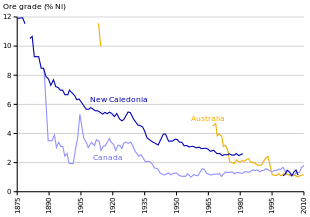
Изменение содержания никелевых руд в некоторых ведущих странах-производителях никеля.
По оценкам, во всем мире добывается более 2,5 миллионов тонн (т) никеля в год: Индонезия (760 000 т), Филиппины (320 000 т), Россия (280 000 т), Новая Каледония (200 000 т), Австралия (170 000 т). ) и Канада (150 000 т), являющиеся крупнейшими производителями по состоянию на 2020 год. Крупнейшие месторождения никеля за пределами России находятся в Финляндии и Греции . Выявленные наземные ресурсы, содержащие в среднем 1% никеля или более, содержат не менее 130 миллионов тонн никеля. Примерно 60% находится в латеритах и 40% — в сульфидных месторождениях. Кроме того, обширные источники никеля находятся в глубинах Тихого океана , особенно в районе, называемом зоной Кларион Клиппертон, в виде полиметаллических конкреций, покрывающих морское дно на глубине 3,5–6 км ниже уровня моря . Эти конкреции состоят из множества редкоземельных металлов, и, по оценкам, никелевый состав этих конкреций составляет 1,7%. Благодаря достижениям современной науки и техники Международным органом по морскому дну в настоящее время вводятся правила, обеспечивающие сбор этих конкреций экологически сознательным образом при соблюдении Целей устойчивого развития Организации Объединенных Наций .
Единственное место в Соединенных Штатах, где добыча никеля была прибыльной, — это Риддл, штат Орегон , где расположены несколько квадратных миль поверхностных залежей никельсодержащего гарниерита . Рудник был закрыт в 1987 году шахты проекта Eagle новый никелевый рудник в Мичиганском «s верхнего полуострова . Строительство было завершено в 2013 году, а эксплуатация началась в третьем квартале 2014 года. За первый полный год работы на руднике Игл было добыто 18 000 тонн.
Причины отравления никелем
Отравление никелем в условиях промышленного производства носит в большинстве случаев хронический характер. В организм человека токсичные соединения никеля попадают в виде промышленных туманов, аэрозолей, паров и производственной пыли, содержащей никель.
Промышленная переработка металлов приводит к накоплению в организме никелевой пыли. Возможно отравление работников сельского хозяйства при обработках растений против вредителей.
Бытовое отравление никелем встречается редко, наблюдается при интенсивном курении, ношении украшений из некачественных никелевых сплавов. Потребление продуктов, богатых никелем, использование никелированной посуды не приводят к избытку металла в организме.
Опасное поле
Начнем с электромагнитного излучения, его источником являются монитор и системный блок компьютера. В человеческом организме многие процессы происходят по тем же законам, которые господствуют и в физике – используя электромагнитное излучение, передачу импульсов и так далее. В первую очередь важна скорость передачи импульсов по нервным окончаниям. У кого-то эти импульсы «бегают» быстрее, у кого-то медленнее. Если у человека есть склонность к так называемой «пароксизмальной активности», «готовность» нервной системы к тому, чтобы выдать неправильный сигнал, «абракадабру», выше. Например, если у человека с такой предрасположенностью имеется какая-либо патология, то она скорее проявится в том случае, если его работа связана с компьютером, нежели у человека, который с компьютером не контактирует. Электромагнитное поле, в чем его вред? Электромагнитное поле может повлиять на передачу импульсов по нервным окончаниям. А это проявление каких угодно заболеваний – от сбоев в вегетативной нервной системе, которая «нервирует» все внутренние органы, до патологии центральной нервной системы, которая обеспечивает умственную деятельность. Проявления могут быть разными – головокружение, неврозы, быстрая утомляемость, повышенная сонливость, заболевания – тики, боли. Чтобы избежать длительного контакта с электромагнитным полем, нужно периодически покидать свое рабочее место за компьютером, таким образом, вы «убьете двух зайцев», ведь постоянная работа за компьютером – это и статическая нагрузка, и малоподвижный образ жизни.
| Врач-невропатолог, к.м.н. Новикова Лариса Вагановна. Начнем с того, что существуют специфические, так называемые «компьютерные стрессоры». Например, потеря информации. Неустойчивая работа, сбои и «зависания» компьютера, даже не приводящие к потере данных, тоже серьезные факторы стресса. Вспомните свою реакцию, когда с экрана исчезает несколько страниц только что набранного текста или упорно не хочет запускаться любимая игрушка. Вы начинаете выходить из себя, нервничать, а это негативно отражается на вашей нервной системе. Старайтесь спокойнее относиться к этим эксцессам, помните о том, что нервные клетки не восстанавливаются. Помимо этого, у людей, которые вынуждены целый день проводить за компьютером, отмечаются нарушения памяти, бессонница, ухудшение зрения, головные боли, хроническая усталость, депрессионное состояние. Причем эти симптомы становятся более выраженными по мере увеличения стажа работы. Не доводите ситуацию до крайности, больше отдыхайте, в выходные старайтесь не лежать дома с книжкой на диване, гуляйте, катайтесь на велосипеде, занимайтесь плаванием. |
История открытия
Получение металла, который уже многие сотни лет с успехом используется человеком, не было связано с научными открытиями, впервые никель попал в руки людям случайно. После падения метеорита его куски были переплавлены на оружие и предметы культа, а использовавшие их воины и жрецы интуитивно поняли особые свойства металла, его удивительную прочность, сочетающуюся с ковкостью.
Интересно, что само название «никель» было презрительным наименованием, переводившимся как «ложная медь», однако постепенно характеристики элемента были по достоинству оценены.
Известно, что ученые древнего Китая еще в 235 году до н. э. писали об удивительном материале пафонге, который и представлял собой никелевый сплав с цинком и медью. Это позволяет сделать вывод о том, что металл начал использоваться человеком очень давно. Позднее сплав был завезен в Европу, где стал применяться для чеканки монет.

Использование металла в промышленности началось во второй половине XVIII столетия, различные его сплавы стали активно использоваться в производстве шпор, оружия и даже в ювелирной отрасли.
Честь открытия никеля в сплаве принадлежит исследователю из Швеции Кронштеду, который установил, что никель — это новый и доселе неизвестный науке металл, а не сплав ранее известных элементов. После смерти шведа его выводы были подтверждены Т. Бергманом.
Проявление гальваноза
Проявления несовместимости металлов могут начаться не сразу, а спустя какое-то время после установки протезов. Пациенты часто считают, что у них непереносимость металла. На самом деле проблемы вызваны микротоками, постоянно действующими на ткани ротовой полости.
Больных беспокоит:
- неприятный металлический или кислый привкус во рту;
- мигрирующая болезненность в челюстях;
- головная боль;
- покраснение, отечность и болезненность языка – глоссалгия;
- ощущение сухости во рту, вызванное воспалением и нарушением работы слюнных желез;
- искажение вкуса – сладкое воспринимается как горькое или кислое, а в некоторых случаях больной вообще не чувствует вкуса пищи;
- отечность десны в месте установки металлических протезов или вокруг зубов с пломбами из амальгамы.
Если вовремя не удалить проблемные конструкции и пломбы, проявление гальваноза будет усиливаться. Есть данные, что это заболевание провоцирует раковые опухоли ротовой полости. Кроме того, гальваноз часто становится причиной болезней десен – пародонтита.
Заболевание долго может протекать в скрытой форме, не давая явных симптомов. Это не значит, что такие больные не испытывают на себе отрицательного влияния установки протезов из разных металлов. Микротоки, превышающие норму, поражают организм, провоцируя образование злокачественных опухолей ротовой полости и мягких тканей лица.
Никель в медицине
Никель в медицине используется очень широко. Для начала возьмем инструменты, необходимые для проведения операции. Результат операции зависит не только от самого врача, но и от качества инструмента, которым он работает. Инструменты подвергаются многочисленным стерилизациям, и если они изготовлены из сплава, в который не входит никель, то коррозия не заставит себя долго ждать. А инструменты, сделанные из стали, которая содержит никель, гораздо дольше служат.
Если говорить об имплантатах, для их изготовления пускают в ход никелевые сплавы. Никельсодержащая сталь обладает высокой степенью прочности. Приспособления для фиксации костей, протезы, винты — все сделано из этой стали. В стоматологии имплантаты тоже заняли свои крепкие позиции. Бюгели, брекеты из нержавеющей стали используют ортодонты.

Классификация месторождений
Добыча металла ведется в нескольких месторождениях, которые принято классифицировать на четыре группы. Первая — медно-никелевые сульфидные, они располагаются на территории Австралии, Канады, стран СНГ. Следующая — никелевые силикатные и кобальт-никелевые силикатные, ферроникелевые оксидно-силикатные. Они имеются в Австралии, Кубе, Индонезии, а также на юге Урала и в Побужье.

Медно-колчеданные месторождения и жильные сульфидно-арсенидные бассейны не имеют столь широкого распространения и считаются второстепенными.
На территории Российской Федерации добыча минерала проводится в следующих основных месторождениях: Октябрьское, Ждановское, Талнахское, Буруктальное. Расположены они на территориях Таймырского АО, Мурманской и Оренбургской областей. Запасы минерала считаются достаточными, в ближайшие столетия его нехватка не ожидается.
Общие сведения об олове.
Олово (Sn) — один из древнейших металлов, полученных человеком в чистом виде. Археологи датируют первые орудия из бронзы (сплава меди и олова) 4-м веком до н.э. На латыни олово звучит как stannum — «стойкий, прочный». Оно является дефицитным тяжелым металлом, что обуславливает его высокую стоимость. В земной коре оно рассеяно в виде касситерита (SnO2), реже — оловянного колчедана или станнина (Cu2FeSnS4).
Олово часто используется как защитное покрытие для внутренней части консервных банок. Несмотря на то, что в атмосферных условиях оно является катодом для жести, в присутствии органических кислот механизм защиты пары Sn/Fe меняется на более эффективный анодный. Это и относительная безопасность олова обусловило его применение (а не, например, цинка) в данных целях. Сегодня есть тенденция замены оловянного покрытия жести на полимерное (далее будет показано почему).
Олово в соединениях проявляет устойчивые валентные состояния +2 и +4. В условиях организма олово может находиться в форме катиона Sn2+ или гидроксидов Sn(OH)2 и xSnO2*yH2O. Несмотря на более характерную для олова высшую степень окисления, в физиологических условиях обе эти формы могут сосуществовать, легко переходя одна в другую (φоSn4+/Sn2+= -0,15В, φоSnO2/SnO = -0,88В).
Лечение и первая помощь при отравлении никелем
В первую очередь надо прекратить доступ никеля в организм. Если это респираторная интоксикация, то пострадавшего следует вывести на свежий воздух. При контактном отравлении никелем следует тщательно промыть руки, кожные покровы и сменить одежду.
Уменьшает всасывание никеля крепкий чай, кофе, молоко и высокие концентрации аскорбиновой кислоты. При респираторной форме отравления показаны щелочные ингаляции. Внутривенно вводятся растворы глюкозы, аскорбиновой кислоты. Назначается симптоматическое лечение при нарушении сердечно-сосудистой функции, почечной недостаточности.
Физико-химические характеристики
Магнитные особенности элемента сохраняются при весьма низких температурах, достигающих -340 °C. Кроме того, спецификой его является отсутствие предрасположенности к коррозии.
Можно выделить следующие физические характеристики металла:

- атомный номер — 28;
- молярная масса — 58,69 а. е. м.;
- удельная теплоемкость — 0,443 Дж/(K· моль);
- температура плавления — 1453 °C;
- температура кипения — от 2730 до 2915 °C.
Особенность никеля — отсутствие негативных реакций при воздействии воздуха или воды. Это обусловлено тем, что на поверхности образуется оксид никеля NiO — защитная пленка, защищающая металл от последующего окисления.
При высоких температурах элемент способен реагировать с кислородом и всеми галогенами. Кроме того, реакция наблюдается при его взаимодействии с аммиаком и азотной кислотой.
Нахождение в природе и производство

Больше всего никеля содержится в глубоких слоях. В земной коре — его 0,0058%, в ультраосновных породах — 0,2 %. Если верить гипотезе, что земное ядро состоит из никелистого железа, общее содержание никеля в земле составляет примерно 3%. Никель также обнаружен в некоторых метеоритах.
В земной коре этот металл соседствует с железом и магнием, с которыми он имеет сходную валентность. В минералах магния и железа никель содержится в виде изоморфной примеси. Также существует 53 известных науке минерала никеля. Большая часть из них была образована под воздействием давления и высоких температур, например, при застывании магмы. Сульфидные руды, содержащие данный металл, имеют в своем составе медь. Некоторые руды никеля включают железо, серу, мышьяк, кобальт, магний.
Больше всего этого металла добывается на территории России. Крупные никелевые рудники также находятся в Канаде, Австралии, Новой Каледонии, Индонезии и на Кубе.
Больше всего никеля (около 80%) получают из сульфидных медно-никелевых руд, значительно меньше — из силикатных (окисленных) руд.
Физические свойства
Никель — ферромагнетик, то есть при температуре ниже точки Кюри он обладает намагниченностью при отсутствии внешнего магнитного поля. Для никеля точка Кюри составляет 358 ⁰С. Металл не тускнеет на открытом воздухе.
Основные физические свойства никеля:
- Структура решетки — кубическая гранецентрированая.
- Плотность при нормальных условиях — 8,902 г/см3.
- Температура плавления — 1453 ⁰С.
- Удельная теплота плавления — 17,61 кДж/моль.
- Температура кипения – 3000 ⁰С.
- Удельная теплота испарения — 378,6 кДж/моль.
- Молярная теплоемкость — 26,1 Дж/(K*моль)
- Удельная теплоемкость — 0,440 кдж/(кг*К).
- Теплопроводность — 90,9 Вт/(м*К).
- Удельное электрическое сопротивление — 0,0684 мкОм*м.
Профилактика
На современных производствах, где существует надлежащий контроль и охрана труда, любое токсическое действие никеля и его соединений можно нивелировать, используя изолирующие респираторы, фильтрующие шланговые противогазы и спецодежду. Работниками должны применяться специальные пасты и мази, кожа рук должна обрабатываться особыми соединениями, но самое главное, что можно сделать – это устранить ручной труд, особенно загрузку и выгрузку деталей из электролизных ванн, и как можно шире применять механизацию на производстве.
Очень важным средством профилактики хронических интоксикаций является проведение периодических медицинских осмотров, а также использование специальных накожных тестовых проб соединениями никеля. В качестве скрининговой диагностики обязательно должна проводиться рентгенография носовых пазух, ежегодные консультации онколога на производстве.
История открытия Никель Niccolum
Открытие элемента Niccolum — Никель (англ., франц. и нем. Nickel) открыт в 1751 г. Однако задолго до этого саксонские горняки хорошо знали руду, которая внешне походила на медную и применялась в стекловарении для окраски стёкол в зелёный цвет. Все попытки получить из этой руды медь оказались неудачными, в связи с чем в конце XVII в. руда получила название купферникель (Kupfernickel), что приблизительно означает «Медный дьявол».
Данную руду (красный никелевый колчедан NiAs) в 1751 г. исследовал шведский минералог Кронштедт. Ему удалось получить зелёный окисел и путём восстановления последнего — новый металл, названный никелем.
Физиологическая роль олова в организме.
Информация о физиологической роли олова в организме человека и животных противоречива. Олово образует больше количество металлоорганических соединений (т.е. соединений, в которых есть хотя бы одна связь Sn-C). К ним относятся тетраалкильные соединения R4Sn, алкилгалогеноводороды R3SnГ, R2SnГ2, RSnГ3, гидроксиды R3SnOH и другие кислородосодержащие соединения, сульфиды R2SnS. В организме олово находится в основном в виде жирорастворимых соединений.
В человеческом теле диспергировано до 0,0002% олова, обычно же — на порядок меньше. По этой причине для человека оно относится к примесным микроэлементам. Ежедневно человек «съедает» 0,02-17 мг олова, особенно при активном потреблении консервов, хранящихся в банках из луженой жести. В кровь олово практически не всасывается, т.к. в результате гидролиза образуются гидроксиды или другие труднорастворимые неорганические соединения. Поступление его в кровь ограничивается значениями 0,02-0,2 мг в сутки (в виде белковых комплексов). Однако, это количество олова быстро распределяется по разным органам. Олово депонируется в скелете (10 мкммоль/кг), печени (2,7), легких (2,4), почках (1,6), коже (1,3). Оно входит в состав желудочного гормона гастрина. Этот гормон регулирует выработку соляной кислоты в желудке и увеличивает секрецию пепсина (пищеварительный фермент, расщепляющий белки).
В опытах на крысах было показано, что малые дозы соединений олова способствуют их росту.
Потребность в олове обычно удовлетворяется обычным питанием. Дефицит наступает при длительном его потреблении менее 1 мг в день. Испытания на лабораторных животных показали, что при нехватке олова замедлялся рост и привес у некоторых видов, нарушался минеральный состав внутренних органов, развивалась алопеция, ухудшался слух.
Физические и химические свойства

В периодической системе Менделеева Ni значится под № 28, и находится в 10 группе 4 периода. Его атомная масса равна 58,69. Никель двухвалентен, Ni(II). Внешне это серебристо-белый с желтоватым оттенком металл с плотностью 8,9 г/см3 и температурой плавления 14530С.
Он хорошо поддается обработке. Устойчив к действию атмосферного воздуха, щелочей, многих кислот. На его поверхности образуется тончайшая оксидная пленка, защищающая металл от дальнейшего окисления. В этой связи его используют в качестве антикоррозийного покрытия – менее устойчивые к коррозии металлы никелируют.

Однако, мелкий никелевый порошок самовозгорается на воздухе. Кроме того, Ni обладает магнитными свойствами, и этим напоминает железо. В земной коре Ni содержится только в виде соединений. Хотя в метеоритах часто встречается самородный металл. Содержание его в земной коре – 5,8 x 10-3%. По этому показателю среди всех элементов таблицы Менделеева он занимает 25 место.
Физиологическая роль никеля.
О роли никеля в человеческом организме ученым известно немного, но все они с уверенностью говорят, что для нормального функционирования наших органов он необходим.
а. Никель участвует в активации некоторых ферментов. Например: ионы Ni2+ участвуют в активации фермента аргиназы. Этот фермент катализирует распад аргинина до орнитина и мочевины. Тем самым никель косвенно способствует выведению азота из нашего тела.
б. Одна из главных функций никеля – участие в процессе кроветворения. На процесс кроветворения никель влияет косвенно, через механизм проникновение в кровь железа. Дело в том, что никель является кофактором (активатором) биолиганда, способного связывать железо и переводить его из нерастворимой формы Fe3+ в легкоусвояемую Fe2+. Железо в дальнейшем используется организмом для образования гемоглобина. Поэтому в случаях больших кровопотерь пациентам в клиниках вводят инъекции никеля, для стимуляции процесса кроветворения. Никель входит в состав клеток крови – эритроцитов.
в. Никель участвует в окислительно-восстановительных процессах организма. Поэтому его концентрация выше в тех органах, в которых постоянно происходят реакции обмена: мышцы, печень, легкие, почки, поджелудочная железа, головной мозг, щитовидная железа.
г. Этот микроэлемент принимает участие в структурной организации и функционировании ДНК, РНК, белков, обеспечивая необходимую конформацию и форму молекул.
д. С помощью никеля в наше тело поступают такие витамины как В12 и С.
е. Существуют данные о том, что он обладает антиадреналиновым эффектом.
При употреблении продуктов питания богатых никелем, в организм этот микроэлемент попадает через желудочно-кишечный тракт. В желудочно-кишечном тракте под действием соляной кислоты никель образует координационные соединения и таким образом попадает в кровь. Транспорт этого элемента осуществляет белок – альбумин, который образует с ним комплексное соединение и разносит никель по всему организму.
Никель способен попадать в клетки посредством образования тройного комплекса с гистидином и транспортным белком, находящимся на поверхности клеточной мембраны.
Где применяется никель
Обширно никель применяется в такой мощной отрасли, как металлургия. А именно в изготовлении самых разнообразных сплавов. В основном в сплав входит железо, никель и кобальт. Существует много сплавов, в основу которых входит именно никель. Соединяется наш металл в сплав, например, с титаном, хромом, молибденом. Никель также используется, чтобы защитить продукцию, которая быстро подвергается коррозии. Эту продукцию никелируют, то есть создают специальное никелевое покрытие, которое не дает коррозии сделать свое противное дело.
Никель — это очень хороший катализатор. Поэтому он активно используется в химической промышленности. Это приборы, химпосуда, аппараты для различного применения. Для химреагентов, продовольствия, доставки щелочей, хранения эфирных масел используют цистерны и резервуары из никелевых материалов. Без этого металла не обходятся в атомной технике, телевидении, в самых разных приборах, список которых очень длинный.
Если заглянуть в такую сферу, как приборостроение, а следом в сферу машиностроения, то можно заметить, что аноды и катоды – это никелевые листы. И это далеко не весь перечень применения такого просто чудесного металла. Не стоит преуменьшать значение никеля и в медицине.

Что такое ХБП и как она протекает
Хроническая болезнь почек (ХБП) включает в себя различные патологические состояния с поражением почечной ткани, имеющие тенденцию к длительному прогрессирующему течению с постепенным нарастанием выраженности почечной недостаточности.
Ее диагностируют при наличии у пациента признаков повреждения или снижения функционирования почек, которые сохраняются не менее 3 месяцев вне зависимости от нозологического диагноза (например, хронического гломерулонефрита, хронического пиелонефрита, сахарного диабета, поликистоза почек, мочекаменной болезни, артериальной гипертензии, cистемной красной волчанки и др.). При этом оценивают изменение скорости клубочковой фильтрации (СКФ) и данные других лабораторно-инструментальных методов исследования выделительной системы.
Диагноз ХБП устанавливается на основании следующих критериев:
- наличие любых признаков повреждения почек, включая измемнения в анализах мочи и крови, подтвержденные с интервалом не менее 3 месяцев;
- любые необратимые структурные изменения органа, выявленные однократно при прижизненном морфологическом исследовании органа или при его визуализации:
- снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин в течение 3 и более месяцев, независимо от наличия других признаков повреждения почек.
Выделяют несколько стадий ХБП, основным критерием при их диагностике является показатель СКФ.
- Имеются признаки повреждения почечной ткани. При этом СКФ нормальна или повышена.
- Легкое снижение СКФ (в пределах 60–89 мл/мин), говорят о незначительных нарушениях.
- Умеренное снижение скорости клубочковой фильтрации (30–59 мл/мин), эту стадию нередко подразделяют на А и Б этапы.
- СКФ снижена значительно (15–29 мл/мин), диагностируют выраженные нарушения.
- Терминальная почечная недостаточность, показатель СКФ падает ниже 15 мл/мин. Требует проведения заместительной почечной терапии.
У пожилых людей патологическим считается уровень СКФ ниже 60 мл/мин. Показатель выше этого считается возрастной нормой, если у пациента при этом отсутствуют «почечные» факторы риска. В таком случае ХБП не диагностируется.






















































